Glaucoma: tipologie, cause, sintomi e trattamento
Cosa causa il glaucoma?
Il glaucoma è un ampio gruppo di malattie oculari progressive caratterizzate da danni al nervo ottico. Non esiste una causa unica e definita, in quanto molti fattori possono contribuire. L’elevata pressione all’interno dell’occhio è un fattore di rischio ben noto, ma non una causa perché il glaucoma può svilupparsi anche con una pressione oculare normale.
Il nervo ottico è un fascio composto da milioni di fibre nervose situato nella parte posteriore dell'occhio. Si occupa di trasportare tutte le informazioni visive raccolte da altre cellule dell'occhio al cervello, dove vengono interpretate come immagini.
Sebbene il glaucoma sia il tipo più comune di danno progressivo del nervo ottico, non è l’unica malattia che può danneggiarlo.
Il glaucoma è un danno al nervo ottico causato dalla pressione all'interno dell'occhio, che esercita uno stress eccessivo verso l'esterno sulle pareti dell'occhio e sul disco ottico, l'area in cui le fibre del nervo ottico lasciano la parte posteriore dell'occhio per connettersi al cervello.
Troppa pressione sulle cellule in quest’area può danneggiarle o addirittura ucciderle. Siccome non possono guarire o ricrescere, la perdita della vista è permanente.
Per questo motivo l’elevata pressione intraoculare (PIO) è un importante fattore di rischio. Molte forme di glaucoma si sviluppano perché si verifica un aumento eccessivo della pressione intraoculare per un periodo di tempo troppo lungo.
Gli esperti ritengono che altri aspetti della struttura dell’occhio, come le dimensioni e lo spessore delle pareti, possano spiegare il modo in cui il nervo ottico gestisce lo stress in questi casi.
Il danno al nervo ottico causato dalla pressione oculare è chiamato danno glaucomatoso. È visibile durante un esame oculistico come una caratteristica "coppettazione" del disco ottico.
Gli oculisti hanno una formazione approfondita nel riconoscere i diversi tipi di danni. Quando rilevano un danno glaucomatoso durante un esame oculistico, lo diagnosticano come glaucoma.
SCOPRI DI PIÙ sulle cause del glaucoma
Cos’è la pressione intraoculare (PIO)?
La PIO è la quantità di stress verso l'esterno esercitata dai fluidi all'interno dell'occhio sulle sue pareti interne. Questo stress, o pressione, è molto importante per mantenere la forma e il corretto funzionamento dell'occhio.
I nostri occhi sono pieni di due tipi di liquidi: umor vitreo e umor acqueo. Entrambi questi fluidi forniscono nutrienti agli occhi, oltre a svolgere altre importanti funzioni.
L'umor vitreo riempie la cavità vitrea, lo spazio nell'occhio tra la parte posteriore del cristallino e la retina. È responsabile della maggior parte del volume e della forma dell’occhio e aiuta anche a sostenere la retina. L'umor acqueo riempie la camera anteriore, lo spazio tra la cornea e la parte anteriore dell'iride. A differenza dell'umor vitreo, l'occhio produce costantemente nuovo umor acqueo. Questo fluido scorre dentro e fuori dalla parte anteriore dell'occhio, rinnovandosi continuamente.
Siccome scorre in modo costante, l’umor acqueo svolge un ruolo fondamentale nel mantenere la pressione ideale dell’occhio. Se qualcosa rallenta la sua capacità di drenare, la pressione oculare rischia di aumentare. Quando gli oculisti misurano la PIO, misurano la pressione dell'umor acqueo.
Sintomi e segni
La maggior parte delle forme di glaucoma raramente presenta sintomi precoci, compreso anche il glaucoma primario ad angolo aperto (POAG), la forma più comune.
Il danno al nervo ottico avviene di solito molto lentamente, nel corso degli anni. Inoltre, è necessario che gran parte delle fibre nervose (circa il 30%) venga danneggiata prima che si noti la perdita della vista. Questo è il motivo per cui il glaucoma è conosciuto come il “ladro silenzioso”.
Quando la perdita della vista diventa evidente, in genere è la visione periferica ad essere colpita per prima. L'unico modo per rilevare il POAG e la maggior parte degli altri tipi di glaucoma prima che si verifichi è mediante esami oculistici annuali completi.
Tuttavia, ci sono alcune forme che solitamente presentano sintomi o segni “precoci”.
Il glaucoma acuto ad angolo chiuso si manifesta molto rapidamente e può causare dolore oculare intenso e improvviso, oltre a mal di testa.
Può anche causare:
nausea
vomito
offuscamento della vista
aloni color arcobaleno attorno alle luci
Se si pensa di avere un glaucoma acuto ad angolo chiuso, si raccomanda di contattare un professionista con urgenza, in quanto questa forma può causare cecità in pochi giorni.
Il glaucoma congenito può spesso essere rilevato da segni visibili. Si tratta di una forma presente alla nascita o che esordisce entro i primi mesi di vita.
I neonati e i bambini affetti da glaucoma congenito presentano spesso occhi notevolmente più grandi del normale, che appaiono offuscati o annebbiati. Altri possibili segni includono:
occhi pieni di lacrime
È possibile che tutti i tipi di glaucoma causino visione offuscata, mal di testa e aloni quando la pressione oculare è sufficientemente elevata. Tuttavia, si tratta di casi rari. È importante notare che, anche se queste forme possono essere evidenti da subito, i loro sintomi e segni non sono realmente “precoci”, ma indicano che il danno al nervo ottico è già ben avviato e che è necessario un trattamento immediato.
Tipologie
Esistono quattro tipi principali di glaucoma e anche diversi sottotipi. La maggior parte si sviluppa perché qualcosa rallenta o impedisce all'umor acqueo di defluire correttamente dalla camera anteriore. I quattro tipi principali sono classificati in modo generico in base alla posizione e alla causa del problema di drenaggio:
Angolo aperto: l’angolo di drenaggio appare normale e aperto. I problemi di deflusso sono presenti a livello microscopico più avanti nel percorso.
Angolo chiuso (chiamato anche angolo stretto): l'angolo di drenaggio stesso è stretto o chiuso, causando problemi di deflusso.
Tensione normale: non è noto alcun problema di deflusso e la PIO rientra nell'intervallo normale.
Secondario: questo tipo può essere ad angolo aperto o ad angolo stretto, ma il problema di drenaggio si sviluppa a seguito di una patologia o lesione che era presente prima.
Quindi, per comprendere i diversi tipi di glaucoma, è utile approfondire come l'umor acqueo scorre attraverso il segmento anteriore.
Il segmento anteriore è costituito da cornea, iride, pupilla, cristallino e corpo ciliare. Lo spazio all'interno del segmento anteriore tra la cornea e il cristallino è chiamato camera anteriore.
Il corpo ciliare è un anello di tessuto e muscolo collegato al lato posteriore dell’iride e ai bordi esterni del cristallino dell’occhio, che regola la forma del cristallino per la messa a fuoco e produce anche tutto l'umor acqueo dell'occhio.
Questo fluido viene secreto dal corpo ciliare e segue un tragitto tra il cristallino e l'iride, per poi defluire nella camera anteriore attraverso la pupilla. Successivamente, abbandona la camera anteriore attraverso una zona denominata angolo di drenaggio, situata all'incrocio tra iride e cornea.
L'angolo di drenaggio incanala il fluido in un'altra struttura chiamata rete trabecolare (TM). La TM è un tessuto complesso che filtra il fluido in uscita dall'occhio. Da lì, il fluido si muove attraverso il canale di Schlemm, un’altra parte del percorso di drenaggio, prima di essere riassorbito dall’organismo.
Esiste anche una seconda via di drenaggio chiamata via di deflusso uveosclerale. Questo percorso bypassa la TM e il fluido drena direttamente attraverso la parete dell'occhio alla base dell'iride e del corpo ciliare.
Quando qualcosa lungo questi percorsi interferisce con il fluido che lascia l’occhio, provoca un aumento della pressione intraoculare che spesso porta al glaucoma.
Se l'angolo di drenaggio è aperto e normale si parla di glaucoma ad angolo aperto. Se è bloccato o ristretto, si parla di glaucoma ad angolo chiuso. Entrambi questi tipi possono essere primari o secondari.
Glaucoma primario
Il glaucoma è considerato primario quando non è possibile individuare alcuna patologia o lesione sottostante come causa.
Ad esempio, se la PIO elevata ha causato danni da stress al nervo ottico, ma non esiste una causa identificabile per la PIO elevata, si tratta di un glaucoma primario. Se la PIO è elevata a causa di un disturbo dell’angolo di drenaggio, ma la causa del disturbo non può essere identificata, anche questa è una forma primaria.
Anche se c’è un danno da stress al nervo ottico in un occhio con una PIO “normale”, parliamo di glaucoma primario.
Le forme ad angolo aperto e ad angolo stretto possono essere entrambe primarie o secondarie. Tuttavia, le due tipologie più comuni sono entrambe primarie.
Glaucoma primario ad angolo aperto (cronico).
Il glaucoma primario ad angolo aperto (POAG) è di gran lunga la forma più comune di questa malattia. Dal 70% al 95% di tutti i casi di glaucoma sono POAG.
In questa forma, l’angolo di drenaggio che conduce alla MT appare soddisfacente, ma il fluido acquoso esce dall'occhio troppo lentamente. La POAG è una malattia cronica che non progredisce rapidamente. È indolore e raramente presenta sintomi prima delle fasi avanzate.
Glaucoma primario ad angolo chiuso (cronico e acuto)
Il glaucoma primario cronico ad angolo chiuso (PACG) è la seconda forma più comune di glaucoma, sebbene sia molto meno frequente rispetto al POAG. Rappresenta solo circa il 10% dei casi di glaucoma, ma è responsabile di circa la metà dei casi di cecità associati al glaucoma.
Chiamato anche glaucoma ad angolo stretto, di solito si verifica perché la pressione dietro l'iride ne causa l'incurvamento in avanti, limitando il flusso acqueo sia nella pupilla (chiamato blocco pupillare) che nell'angolo di drenaggio. Con il progressivo accumularsi del fluido dietro l'iride, l'incurvamento diventa più intenso.
Il PACG può anche essere correlato alla posizione naturale e/o alle dimensioni dell'iride o del corpo ciliare. In alcuni occhi, l'iride è più spessa o leggermente più avanti nell'angolo. In altri, il corpo ciliare è troppo grande per l'occhio o troppo vicino alla parte posteriore dell'iride.
Questi tratti anatomici, noti come plateau dell’iride, causano l'affollamento dello spazio e angoli naturalmente stretti.
Il PACG può essere cronico (l'angolo si restringe lentamente o in modo intermittente) o acuto (l'angolo si restringe o si chiude improvvisamente). La chiusura acuta dell’angolo è molto rara. Solo circa il 30% delle persone affette da PACG sperimenta un episodio acuto. La chiusura acuta dell’angolo può anche essere dovuta a lesioni o altre cause secondarie.
Si tratta di un’emergenza medica che può portare alla cecità nel giro di uno o due giorni e richiede quindi un trattamento medico immediato.
Glaucoma a pressione bassa o normale
Nel glaucoma a pressione normale (NTG), chiamato anche glaucoma a pressione bassa (LTG), si verificano danni al nervo ottico e perdita della vista anche se la pressione intraoculare rientra nell'intervallo medio. Il NTG è solitamente etichettato come un sottotipo di glaucoma ad angolo aperto ed è abbastanza comune.
Gli esperti hanno diverse teorie su come si sviluppa il NTG senza una PIO elevata. Ad esempio, potrebbe essere correlato a uno scarso apporto di sangue al nervo ottico o il nervo ottico stesso potrebbe essere particolarmente sensibile alla pressione normale. È anche possibile che il diametro dell’occhio, lo spessore della parete e lo spessore della cornea influenzino il modo in cui la pressione influisce sul nervo ottico.
Glaucoma congenito primario
I glaucomi infantili sono rari e si verificano solo nello 0,0023% circa dei bambini. Esistono due forme primarie: glaucoma congenito primario (PCG) e glaucoma giovanile ad angolo aperto (JOAG). Il PCG rappresenta dal 50% al 70% di tutti i glaucomi infantili, ma esistono anche diverse forme secondarie.
Il PCG può essere presente alla nascita, ma l'età di esordio è spesso compresa tra 3 e 9 mesi. A differenza della maggior parte degli altri tipi, il PCG è aggressivo e può causare gravi danni a tutto l'occhio.
I bambini con PCG presentano anomalie nello sviluppo del sistema di drenaggio degli occhi. Le anomalie portano ad un accumulo di liquidi e a una pressione intraoculare più elevata. Ma, siccome gli occhi dei bambini sono ancora morbidi e malleabili, il fluido extra fa sì che gli occhi si allunghino e diventino troppo grandi, causando danni non riscontrati negli adulti con glaucoma.
I bulbi oculari ingranditi, chiamati buftalmo, sono un segno comune di PCG.
SCOPRI DI PIÙ sui glaucomi infantili
Glaucoma secondario
Il glaucoma è considerato secondario quando si sviluppa per cause note.
Ad esempio, lesioni agli occhi o effetti collaterali di alcuni farmaci possono portare a un aumento della pressione intraoculare e al glaucoma. Anche altre patologie, comprese alcune malattie oculari, possono contribuire al danno glaucomatoso del nervo ottico. A questo disturbo sono associati anche diversi tipi di sindromi.
Esistono molti più tipi di glaucoma secondario rispetto a quello primario, ma rappresentano solo il 10% circa di tutti i glaucomi diagnosticati nel mondo.
Glaucoma neovascolare
Il glaucoma neovascolare (NVG) si sviluppa a causa della crescita di nuovi vasi sanguigni sull'iride.
Questi nuovi vasi sanguigni possono diventare così numerosi da bloccare l’angolo di drenaggio dell’occhio. Sono anche più deboli dei vasi sanguigni sani; di conseguenza, tendono a rompersi e a perdere sangue, intasando il sistema di drenaggio.
La causa più comune di neovascolarizzazione dell'iride è la mancanza di flusso sanguigno nella retina. Nella maggior parte dei casi, questo è dovuto alla retinopatia diabetica o all’occlusione della vena retinica centrale (CRVO).
Glaucoma pigmentario e sindrome da dispersione di pigmento
In alcuni occhi, la dimensione e/o la posizione dell'iride possono far sì che sfreghi contro il cristallino. Quando ciò accade, l’attrito può spostare minuscoli granuli del pigmento dell’iride, che si fanno poi strada nella parte anteriore dell'occhio. In questo caso si parla di sindrome da dispersione di pigmento.
Questi granuli possono finire per ostruire o bloccare l'angolo di drenaggio e causare un aumento della pressione intraoculare. Se il blocco porta a danni al nervo ottico, si parla di glaucoma pigmentario.
Il glaucoma pigmentario rappresenta solo circa l'1,5% di tutti i glaucomi, ma entrambe le forme tendono ad essere più comuni tra i maschi bianchi che soffrono di mPIOia.
Glaucoma esfoliativo
Questa forma è simile per molti aspetti al glaucoma pigmentario. Il glaucoma esfoliativo (EG), spesso indicato come glaucoma pseudoesfoliativo (PXG), si sviluppa a causa della sindrome esfoliativa, una sindrome sistemica per la quale il corpo produce un tipo di “forfora interna”.
Minuscole scaglie di detriti cellulari si accumulano nei tessuti e negli organi di tutto il corpo, compresi gli occhi. Se attorno all’angolo di drenaggio si accumula una quantità sufficiente di questo materiale, la pressione intraoculare può aumentare e causare danni al nervo ottico. In questo caso parliamo di glaucoma esfoliativo o glaucoma pseudoesfoliativo.
Il PXG è il tipo più comune di glaucoma secondario.
Glaucoma uveitico
Questa forma si sviluppa in seguito all'uveite, l'infiammazione dell'uvea. L’uvea è lo strato intermedio della parete dell’occhio e, nella parte anteriore, si allontana dalla parete per formare il corpo ciliare e l’iride.
Esistono diversi tipi di uveite e diversi fattori scatenanti.
L’infiammazione può colpire l’intero segmento anteriore e influenzare il flusso acqueo in più modi contemporaneamente.
A seconda delle strutture interessate, il glaucoma uveitico può essere ad angolo aperto o chiuso e può essere cronico o acuto. È considerata una delle forme più impegnative da trattare. Se si notano sintomi di uveite, si raccomanda di consultare immediatamente un oculista.
Glaucoma traumatico
Quando un occhio subisce qualsiasi tipo di lesione o trauma, l'infiammazione e/o il danno ai tessuti e alle strutture interne spesso portano a un aumento della pressione intraoculare. Si stima che dal 3% al 10% di chi subisce un trauma oculare alla fine sviluppi un glaucoma traumatico.
Gli infortuni sono spesso dovuti a sport, aggressioni, cadute e incidenti sul lavoro. Tuttavia, in rari casi, questa forma può svilupparsi anche dopo un intervento chirurgico intraoculare, come l'intervento della cataratta, a causa di una reazione autoimmune che può verificarsi dopo l’intervento.
Il glaucoma traumatico può essere “ad esordio precoce” o “ad esordio tardivo”. In molti casi, possono volerci mesi e persino anni prima che il danno all’interno dell’occhio porti al glaucoma.
Il glaucoma da recessione dell’angolo è una forma ad esordio tardivo causata da un infortunio. Un colpo all'occhio può spostare il fluido acquoso con una forza sufficiente a spingere indietro l'angolo di drenaggio, lacerando anche i tessuti del trabecolato e del corpo ciliare.
Nel corso del tempo, queste lacrime formano cicatrici che rallentano il deflusso e aumentano la PIO.
Glaucoma da topiramato
Il topiramato è un farmaco che tratta l'emicrania, le convulsioni e il dolore neuropatico. In alcune persone, può causare glaucoma ad angolo chiuso secondario. Fortunatamente, si tratta di un effetto collaterale raro che si verifica solo in tre persone su 100.000 che assumono il farmaco.
Questa forma tende a colpire entrambi gli occhi, a differenza del PACG, che di solito si verifica solo in un occhio. La pressione oculare solitamente aumenta in entrambi gli occhi entro le prime settimane di assunzione di topiramato.
Glaucoma indotto da steroidi
I medici prescrivono corticosteroidi per la gestione del dolore, dell’infiammazione e del gonfiore. Possono essere assunti in molte forme, come pillole, iniezioni, spray nasali e colliri o unguenti.
Tutte le forme di steroidi aumentano il rischio di PIO elevata, ma alcuni tipi di steroidi e alcuni metodi di applicazione presentano un rischio maggiore rispetto ad altri. Quando la pressione intraoculare aumenta dopo l’assunzione di farmaci steroidei, si parla di “risposta steroidea”.
Le persone più a rischio di glaucoma indotto da steroidi includono chi ha:
già il glaucoma
una storia familiare di glaucoma
il diabete di tipo 1
una mPIOia elevata
meno di 6 anni
alcune malattie del tessuto connettivo
subito una cheratoplastica penetrante (intervento di sostituzione della cornea)
SCOPRI DI PIÙ sui tipi di glaucoma secondario
Diagnosi e trattamento
Siccome il glaucoma presenta raramente sintomi evidenti, la chiave per il rilevamento e la diagnosi è sottoporsi regolarmente a esami oculistici completi, che consentono all’oculista di monitorare la salute generale degli occhi ed eseguire ulteriori test se riscontra segni di malattie oculari, tra cui il glaucoma.
L’oculista può anche eseguire i test durante gli esami oculistici se si è considerati a rischio glaucoma, ossia se qualcosa nei precedenti esami o nella storia medica mostra che è presente un rischio più elevato di sviluppare questa patologia.
In alcuni casi, gli oculisti eseguiranno questi test se i pazienti riscontrano determinati sintomi visivi, come punti ciechi, visione a tunnel o aloni colorati attorno alle luci.
Il medico di solito discute immediatamente i risultati con il paziente. Se i risultati mostrassero ulteriori segni di glaucoma, potrebbe raccomandare opzioni di trattamento e/o esami più frequenti per monitorare la progressione.
Come viene diagnosticato il glaucoma?
Il glaucoma può essere diagnosticato solo attraverso una serie di test eseguiti da un oculista o un optometrista. I test includono molte delle stesse procedure che fanno parte di un tipico esame oculistico completo, più alcune specializzate.
Come durante un normale controllo medico, ti verranno fatte prima domande sulla tua storia medica. Quindi, a seconda dell'ordine in cui vengono eseguiti i test, si procederà a dilatare le pupille o intorpidire gli occhi con un collirio.
Per alcuni test è necessaria la dilatazione della pupilla, ma non sempre servono gocce anestetizzanti. I test per il glaucoma sono non invasivi e indolori. Le gocce anestetizzanti ti aiuteranno a non sbattere le palpebre quando il medico ti tocca gli occhi.
Test perimetrico: la perimetria, o test del campo visivo, mostra se il tuo campo visivo è stato compromesso. La perdita della vista nel glaucoma inizia tipicamente dalla visione periferica. Questo test la controllerà, ma potrà anche determinare se la visione centrale è interessata.
Esistono due tipi di perimetria: statica e cinetica. Durante la perimetria statica la macchina presenta punti di luce di un solo livello di luminosità. Questo test viene utilizzato per rilevare se la visione periferica è normale o anormale.
Durante la perimetria cinetica la macchina presenta luci di diversa intensità. La perimetria cinetica misura il grado di perdita di campo periferico. Si tratta di un test che richiede più tempo, ma è il modo migliore per seguire la progressione del glaucoma.
Il campo visivo è spesso normale nella fase iniziale del glaucoma; quindi, potrebbe non essere necessario eseguire questo test così spesso.
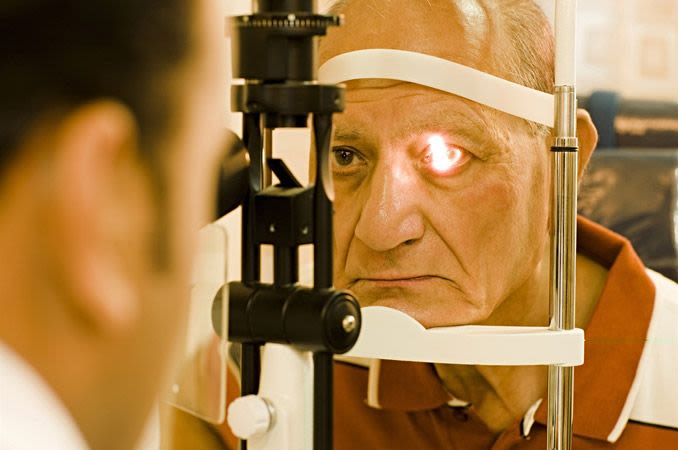
Tonometria: Questo test viene utilizzato per misurare la pressione intraoculare (PIO). Esistono tre tipi fondamentali: tonometria ad applanazione, senza contatto e a indentazione elettronica.
Nella tonometria ad applanazione, si appoggia il mento e la fronte sul microscopio con lampada a fessura. Il medico osserva attraverso la lampada a fessura mentre un dispositivo molto piccolo tocca brevemente la cornea per effettuare la misurazione. La tonometria ad applanazione è considerata la forma più accurata per controllare la PIO.
Nella tonometria senza contatto, chiamata anche NCT o tonometria a soffio, nessun dispositivo tocca l’occhio. Il paziente viene posizionato di fronte a uno strumento che emette un leggero soffio d'aria che arriva fino agli occhi. Il soffio d'aria appiattisce brevemente il centro della cornea per misurare la pressione oculare. L'NCT non è la misurazione più accurata ma può essere utile in alcune circostanze.
Nella tonometria elettronica a contatto, il medico utilizza un dispositivo che assomiglia a una penna per applicare delicatamente una pressione sulla cornea. La "penna" genera una lettura che viene visualizzata su uno schermo. Esistono diverse versioni di questo tipo di tonometria che possono variare leggermente.
Pachimetria corneale: Questo test misura lo spessore della cornea, che è importante nello screening del glaucoma per due motivi.
Il primo è che il tessuto corneale più sottile è un noto fattore di rischio per lo sviluppo del glaucoma. Il secondo è che lo spessore o la sottigliezza di questo tessuto può influire sull'accuratezza della misurazione della PIO. Esistono due tipologie di pachimetria: ad ultrasuoni e ottica.
Nella pachimetria ad ultrasuoni, il medico tocca la cornea con una piccola sonda che ne misura lo spessore mediante onde ultrasoniche. In quella ottica, l'occhio non viene toccato. Il medico utilizza un accessorio speciale per il microscopio con lampada a fessura in grado di misurare lo spessore della cornea con confronti di immagini divise dell’endotelio della cornea.
Gonioscopia: consente all'oculista di visualizzare l'angolo di drenaggio dell'occhio.
Questo angolo è di dimensioni ridotte e si trova in un punto difficile da vedere; quindi, l'oculista utilizza un dispositivo speciale chiamato goniolens. Il goniolens ha la forma di una lente a contatto che si adatta leggermente alla cornea. Contiene prismi che funzionano come specchi per riflettere l'angolo “nascosto”.
Il medico utilizza l'ingrandimento della lampada a fessura in combinazione con il goniolens per vedere se l'angolo è aperto o chiuso, esaminando l'angolo per individuare eventuali elementi che potrebbero bloccarlo, come cicatrici, recessione dell'angolo e plateau dell’iride. Verificherà anche la presenza di eventuali ostruzioni, come pigmenti, detriti di pseudoesfoliazione e nuovi vasi sanguigni (neovascolarizzazione).
Esame del fondo oculare: Un esame del fondo oculare è un esame oculistico dilatato che consente al medico di osservare la retina e il nervo ottico nella parte posteriore dell'occhio.
Il medico utilizza la lampada a fessura, uno speciale strumento portatile o entrambi, per ottenere una visione ingrandita di queste strutture. Questa parte del test è fondamentale per determinare se il nervo ottico e le cellule della retina sono stati danneggiati.
Monitoraggio del nervo ottico: Durante l'esame, l'oculista può anche eseguire alcune scansioni o immagini del nervo ottico. L’imaging del nervo ottico può essere estremamente utile per monitorare eventuali problemi.
Le foto stereoscopiche del papilla ottica consentono al medico di monitorare l'aspetto del nervo ottico. Forniscono una visione della profondità e delle dimensioni della “coppettazione” al centro del disco ottico. Le foto stereoscopiche erano standard in passato, ma sono state in gran parte sostituite dall’imaging con tomografia a coerenza ottica (OCT).
L'imaging OCT è un modo accurato per valutare lo spessore dei diversi strati della retina. I due strati più importanti per il glaucoma sono lo strato delle fibre nervose retiniche (RNFL) e il complesso delle cellule gangliari (GCC).
Controllare l'RNFL in un'area vicino al nervo ottico è un modo molto sensibile per rilevare il glaucoma precoce. Le immagini del GCC, che si trova al centro della retina (la macula), possono essere confrontate con le immagini dell'RNFL per monitorare in modo accurato la progressione nel tempo.
Quali opzioni di trattamento sono disponibili?
Il trattamento medico per il glaucoma si concentra sulla riduzione della pressione intraoculare del paziente. Anche se questa non è una causa del glaucoma, è il fattore di rischio che i medici possono modificare con maggior successo.
Nella maggior parte dei casi, ridurre la PIO può rallentare o arrestare il danno progressivo arrecato al nervo ottico. Tuttavia, qualsiasi danno già presente è permanente e non può essere curato.
Sebbene tutti i trattamenti mirino a ridurre la pressione intraoculare, i più adatti a ciascun paziente dipenderanno dal tipo di glaucoma e da quanto è avanzato. Altri fattori che determinano le opzioni di trattamento includono se in precedenza sono stati eseguiti interventi chirurgici agli occhi e quanto è necessario abbassare la PIO.
Esistono tre terapie principali: farmaci, laser e chirurgia.
Farmaci: la prima strategia di cura sono generalmente i colliri con prescrizione. In alcuni casi vengono utilizzati anche farmaci per via orale, ma meno di frequente. Esistono diversi tipi di colliri per curare questa patologia e ognuno riduce la PIO in modi diversi.
Alcuni aumentano la velocità con cui l'umor acqueo fuoriesce dall'occhio, altri diminuiscono la quantità di umor acqueo prodotto dal corpo ciliare, mentre altri entrambi. È anche abbastanza comune che gli oculisti prescrivano una combinazione di diversi colliri.
Gli analoghi delle prostaglandine agiscono aumentando il deflusso uveosclerale.
Analoghi delle prostaglandine: latanoprost, travoprost, bimatoprost e tafluprost
I betabloccanti, gli agonisti alfa adrenergici e gli inibitori dell'anidrasi carbonica agiscono riducendo la quantità di umor acqueo prodotto dal corpo ciliare.
Betabloccanti: timololo e levobunololo
Agonisti alfa adrenergici: brimonidina e apraclonidina
Inibitori dell’anidrasi carbonica: dorzolamide, acetazolamide e metazolamide
Gli anticolinergici agiscono aumentando il deflusso acquoso attraverso la rete trabecolare.
Anticolinergici: pilocarpina
I donatori di ossido nitrico possono ridurre la produzione di umor acqueo e aumentare il deflusso attraverso il trabecolato.
Donatori di ossido nitrico: latanoprostene bunod
Gli agonisti delle prostaglandine EP2 possono aumentare il deflusso sia della rete uveosclerale che trabecolare.
Agonisti della prostaglandina EP2: omidenepag isopropil
Gli inibitori della Rho chinasi possono ridurre la PIO in tutti e tre i modi. Insieme agli agonisti alfa adrenergici, possono anche rafforzare il nervo ottico contro il danno glaucomatoso.
Inibitori della Rho chinasi: netarsudil mesilato
Per massimizzare la loro efficacia, è fondamentale utilizzare i colliri per il glaucoma in modo coerente e secondo le istruzioni del medico. Se si notano effetti collaterali, si raccomanda di contattare un medico per capire se provare altri farmaci, usare il collirio meno spesso o in modo diverso.
Marijuana: l’American Academy of Ophthalmology, l’American Glaucoma Society e la Canadian Ophthalmological Society concordano tutte sul fatto che le persone affette da glaucoma non dovrebbero assumere marijuana per curare questa patologia.
La marijuana può abbassare la pressione intraoculare, ma anche quella sanguigna. Ciò significa che il nervo ottico, già danneggiato, riceve meno flusso sanguigno per diverse ore dopo l'assunzione di THC.
I pericoli derivanti dalla riduzione dell’afflusso di sangue al nervo ottico superano di gran lunga qualsiasi beneficio che la marijuana può avere sulla PIO.
SCOPRI DI PIÙ sui farmaci per il glaucoma
Procedure laser: come i colliri, gli interventi laser abbassano la PIO migliorando il drenaggio o riducendo la produzione di umore acqueo. Di solito sono il trattamento alternativo preferito se i colliri non riducono abbastanza la PIO.
Possono anche essere una buona opzione per i pazienti che manifestano effetti collaterali dovuto ai colliri o che non sono in grado di usarli in modo coerente. In alcuni casi, i medici possono addirittura raccomandare la chirurgia laser prima o in combinazione con il collirio. Un recente studio ha dimostrato che le procedure laser possono essere un efficace trattamento di prima linea.
Gli effetti della maggior parte delle procedure laser durano solo pochi anni; quindi, potrebbe essere necessario eseguirle più di una volta. Tuttavia, per molti pazienti, queste procedure ambulatoriali possono ritardare o addirittura prevenire interventi chirurgici più invasivi in un secondo momento.
Trabeculoplastica: le trabeculoplastiche laser sono spesso utilizzate per trattare il POAG. Abbassano la PIO creando aperture nel tessuto trabecolare ostruito. Le forme più comuni sono la trabeculoplastica laser selettiva (SLT) e la trabeculoplastica laser ad argon (ALT).
Ciclofotocoagulazione (CPC): questa procedura utilizza l'energia laser per restringere i tessuti del corpo ciliare e ridurre la produzione di umore acqueo.
Iridotomia periferica laser (LPI): viene eseguita principalmente per il trattamento del glaucoma ad angolo chiuso. Possono anche aiutare a prevenire la chiusura dell'angolo nei pazienti che hanno angoli di drenaggio stretti. Questa procedura migliora il deflusso acqueo creando un piccolo foro nell'iride in modo che il fluido possa oltrepassare il blocco pupillare.
Fotocoagulazione panretinica diffusa: per i pazienti affetti da glaucoma neovascolare, questo trattamento rimuove lo stimolo che provoca la formazione di vasi sanguigni anomali. Inoltre, provoca il restringimento e la scomparsa dei vasi sanguigni anomali presenti.
Microchirurgia (chiamata anche filtraggio o chirurgia incisionale): queste procedure sono solitamente il passo successivo se i colliri e la chirurgia laser non abbassano sufficientemente la PIO. In modi diversi, ognuna agisce sulla PIO modificando chirurgicamente il modo in cui il fluido lascia l'occhio.
Sono più invasive dei trattamenti laser e hanno periodi di recupero più lunghi perché comportano delle incisioni. Tuttavia, queste sono minuscole. Si parla di microchirurgia perché gli oculisti eseguono queste procedure utilizzando microscopi e strumenti chirurgici incredibilmente piccoli.
I benefici della microchirurgia possono durare diversi anni, ma non sono permanenti. Fortunatamente, è possibile ripetere la maggior parte degli interventi quando necessario.
Trabeculectomia: questa procedura crea un piccolo lembo, o tasca “filtrante”, sotto la palpebra nella sclera (la parte bianca dell’occhio). Viene rimosso anche un minuscolo pezzo della rete trabecolare sotto il filtro. Il fluido acquoso riesce così ad aggirare le strutture di drenaggio ostruite e lasciare l'occhio.
La tasca impedisce inoltre ai liquidi di defluire troppo rapidamente. Il fluido si accumula nel filtro, formando una piccola bolla sotto la congiuntiva chiamata vescicola.
Canaloplastica: questa procedura funziona dilatando il canale di Schlemm (SC) con un microcatetere. Il SC è la parte del percorso di drenaggio in cui scorre il fluido acquoso attraverso la rete trabecolare.
MIGS (chirurgia mini-invasiva del glaucoma): Le procedure MIGS possono essere pensate come microchirurgie a incisione. Sono meno invasive perché le incisioni vengono praticate nella cornea anziché nella sclera.
Esistono diversi tipi di MIGS che riducono la PIO con vari metodi. Molti di essi comportano il posizionamento di stent o shunt molto piccoli all'interno dell'angolo dell'occhio. Si tratta di opzioni efficaci per i pazienti con glaucoma precoce o lieve, ma alcuni possono essere eseguiti solo in combinazione con la chirurgia della cataratta.
Impianti di drenaggio: consentono al fluido acquoso di lasciare l'occhio attraverso tubi o shunt. La base, o “piastra”, dell’impianto è incorporata tra la congiuntiva e la sclera per mantenerlo in posizione. Il tubo o shunt si estende dalla placca nella camera anteriore. Da lì, il fluido scorre attraverso il tubo nello spazio tra la sclera e la congiuntiva per essere riassorbito dall'organismo.
Iridectomia periferica: questa procedura tratta il glaucoma ad angolo chiuso e comporta la rimozione di una piccola porzione del bordo dell’iride. Funziona allo stesso modo di un LPI per risolvere il blocco pupillare.
Impianto biodegradabile per la somministrazione di farmaci (Durysta): non si tratta di un intervento chirurgico, sebbene l'impianto venga iniettato nell'occhio con un ago. Una volta nell'occhio, la minuscola capsula rimane nell'angolo di drenaggio e per 90 giorni rilascia una dose costante di farmaco per curare il glaucoma. Dopo che la capsula si è sciolta, gli effetti possono durare fino a 24 mesi per alcuni pazienti. Tuttavia, il trattamento può essere effettuato solo una volta per occhio.
SCOPRI DI PIÙ sulla chirurgia del glaucoma
Fattori di rischio e prevenzione
Chiunque può sviluppare il glaucoma: 80 milioni di persone in tutto il mondo, dai neonati agli anziani, soffrono di questa patologia. Attualmente non esiste una cura né un modo per prevenirlo. Tuttavia, conosciamo molti importanti fattori di rischio.
Comprendere questi fattori è fondamentale per sottoporsi a controlli oculistici con la frequenza necessaria, in modo da rilevarli tempestivamente, prima che si manifesti una perdita significativa della vista. Con una diagnosi precoce, è possibile rallentare o addirittura prevenire ulteriori danni al nervo ottico.
Tra le persone a rischio maggiore di glaucoma troviamo:
chi ha una PIO elevata
chi ha più di 40 anni
chi ha una storia familiare di glaucoma
chi ha origini africane, asiatiche o latinoamericane
chi soffre di determinate patologie mediche, come diabete e ipertensione
chi assume determinati farmaci, in particolare steroidi
chi ha subito lesioni o interventi chirurgici agli occhi
chi ha cornee sottili
chi ha sofferto di altre patologie oculari, tra cui infezioni, infiammazioni, tumori o distacco della retina
chi soffre di mPIOia
chi soffre di ipermetropia
Per prevenire la perdita della vista dovuta al glaucoma è fondamentale sottoporsi a esami oculistici annuali completi, anche se la vista sembra normale. Quando un oculista sospetta il glaucoma o inizia un trattamento, potrebbe raccomandare visite più frequenti.
Come appare il glaucoma
Le immagini che seguono illustrano ciò che le persone vedono nelle fasi iniziali e avanzate del glaucoma, offrendo un aiuto nel riconoscere eventuali sintomi. Tuttavia, non dovresti attendere la loro insorgenza per cercare un trattamento.
La perdita della visione periferica non è quasi mai il primo problema riscontrato dai pazienti affetti da glaucoma. È normale che la vista sia leggermente offuscata e che il paziente abbia bisogno di più illuminazione del solito per vedere chiaramente un oggetto. Tuttavia, nella maggior parte dei casi, i pazienti affetti da glaucoma non notano alcun cambiamento precoce della vista.

Gli individui che hanno superato le fasi iniziali del glaucoma possono avere problemi con la chiarezza e la differenziazione dei colori. Può essere come guardare attraverso un paio di occhiali sporchi. Inizieranno anche a riscontrare una perdita della visione periferica, anche se potrebbero non notarla.

Con il glaucoma, la perdita della vista di solito inizia da quella periferica. La visione periferica comprende i bordi esterni attorno all'intero campo visivo. Nelle fasi iniziali, quest’area inizia a svanire.

Con il progredire del glaucoma, la visione periferica si riduce gradualmente. Tuttavia, il cervello spesso ignora a lungo le aree offuscate della visione laterale, motivo per cui la maggior parte delle persone non si rende conto della perdita visiva nelle fasi iniziali.

Quando pensiamo alla visione periferica, spesso immaginiamo qualcosa di simile alle due immagini precedenti. Ma questa comprende anche le periferiche nasali (visione verso il naso) e le periferiche superiori e inferiori. Anche queste aree possono andare perdute.
Se non trattato, il glaucoma comprometterà progressivamente l'intero campo visivo, lasciando ben poca, se non alcuna, vista. La perdita della vista è irreversibile e non può essere recuperata o ripristinata con un trattamento.
Quando contattare un oculista
È importante sottoporsi regolarmente a esami oculistici, anche se non si corre un rischio di glaucoma. L'American Optometric Association raccomanda esami oculistici annuali completi per tutti a partire dai 6 anni. Questi esami controllano tutti i tipi di malattie degli occhi e spesso possono anche rilevare altre patologie.
Tuttavia, è particolarmente importante che le persone a rischio più elevato di glaucoma si sottopongano a controlli oculistici regolari. Questa patologia di solito non presenta alcun sintomo finché non si verifica una significativa perdita della vista. Quindi è importante non aspettare che si manifestino i sintomi prima di consultare un oculista.
Se si notano fattori di rischio o sintomi, si raccomanda di programmare un esame oculistico completo. Questo è anche un buon momento per porre eventuali domande, come ad esempio:
con quale frequenza dovresti, in particolare, sottoporti a esami oculistici?
qual è la misurazione della PIO (pressione oculare) e cosa significa?
quali cambiamenti nello stile di vita sono raccomandati per la salute degli occhi?
se hai il glaucoma, di che tipo è?
è ereditario? I tuoi figli sono a rischio più elevato?
è stabile o progredisce?
i farmaci attuali preverranno alcuni trattamenti?
per quali terapie sei un buon candidato?
cosa accadrà se rinunci al trattamento?
Anche Adam Debrowski e Autumn Sprabary hanno contribuito a questo articolo.
Glaucoma. Johns Hopkins Medicine. Accessed March 2023.
Glaucoma. American Optometric Association. Accessed March 2023.
Glaucoma FAQs | Wills Eye Hospital. Wills Eye Hospital. Accessed March 2023.
What is glaucoma? Glaucoma Research Foundation. Accessed March 2023.
Glaucoma: What every patient should know. Wilmer Eye Institute, Johns Hopkins School of Medicine. Accessed March 2023.
Optic nerve. Cleveland Clinic. January 2022.
Neuroprotective strategies for retinal ganglion cell degeneration: current status and challenges ahead. International Journal of Molecular Sciences. March 2020.
Eye pressure. American Academy of Ophthalmology. EyeSmart. May 2022.
Intraocular pressure. StatPearls [Internet]. July 2022.
Aqueous humor & vitreous humor. Cleveland Clinic. December 2022.
Glaucoma. National Eye Institute. April 2022.
Types of glaucoma. National Eye Institute. September 2021.
Glaucoma. Cleveland Clinic. November 2022.
Glaucoma warning signs. Glaucoma Research Foundation. May 2022..
Optic nerve cupping. Glaucoma Research Foundation. March 2022.
Glaucoma and the importance of the eye's drainage system. BrightFocus Foundation. April 2018.
The trabecular meshwork: Structure, function and clinical implications. A review of the literature. Journal Français d'Ophtalmologie. September 2020.
Open angle glaucoma. World Glaucoma Association. Accessed March 2023.
What is chronic angle-closure glaucoma? American Academy of Ophthalmology. EyeSmart. December 2021.
Overview of eye trauma. Merck Manual Professional Version. September 2022.
Drainage system of the eye. World Glaucoma Association. Accessed March 2023.
Ciliary body. A.D.A.M. Medical Encyclopedia [Internet]. Ebix, Inc. September 2021.
Primary open-angle glaucoma. Merck Manual Professional Version. September 2022.
Open angle glaucoma. StatPearls [Internet]. August 2022.
Unconventional aqueous outflow. American Academy of Ophthalmology. EyeWiki. March 2023.
The genetics of glaucoma. Glaucoma Research Foundation. March 2022.
Glaucoma: Facts & figures. BrightFocus Foundation. October 2022.
Angle-closure glaucoma. Merck Manual Professional Version. September 2022.
Plateau iris. American Academy of Ophthalmology. EyeWiki. December 2022.
Primary vs. secondary angle closure glaucoma. American Academy of Ophthalmology. EyeWiki. February 2023.
Normal tension glaucoma. American Academy of Ophthalmology. EyeWiki. April 2022.
Normal tension glaucoma. Wills Eye Hospital. Accessed March 2023.
Normal tension glaucoma: Review of current understanding and mechanisms of the pathogenesis. Eye. February 2018.
Latest developments in normal-pressure glaucoma: Diagnosis, epidemiology, genetics, etiology, causes and mechanisms to management. Asia-Pacific Journal of Ophthalmology. December 2019.
Normal-tension glaucoma. BrightFocus Foundation. August 2021.
Pediatric glaucoma: types, tests and treatments. Optometry Times. May 2020.
Childhood Glaucoma Research Network classification and epidemiology of childhood glaucoma. American Academy of Ophthalmology. EyeWiki. July 2022.
Primary Congenital Glaucoma. American Academy of Ophthalmology. EyeWiki. August 2022.
Buphthalmos. StatPearls [Internet]. December 2022.
Neovascular glaucoma. American Academy of Ophthalmology. EyeWiki. November 2022.
What is neovascular glaucoma? BrightFocus Foundation. July 2021.
Pigment dispersion glaucoma. StatPearls [Internet]. August 2022.
Pseudoexfoliative glaucoma. American Academy of Ophthalmology. EyeWiki. December 2022.
Uveitis. National Eye Institute. November 2021.
Pathogenesis of uveitic glaucoma. Journal of Current Glaucoma Practice. September-December 2018.
Uveitic glaucoma. American Academy of Ophthalmology. EyeWiki. August 2022.
Traumatic glaucoma. StatPearls [Internet]. August 2022.
Traumatic glaucoma. American Academy of Ophthalmology. EyeWiki. February 2023.
Lens induced glaucomas. American Academy of Ophthalmology. EyeWiki. December 2021.
He kept his eye on the ball. Review of Optometry. July 2020.
Angle recession glaucoma. American Academy of Ophthalmology. EyeWiki. February 2023.
Steroid-induced glaucoma. American Academy of Ophthalmology. EyeWiki. March 2022.
Fast facts about vision loss. Division of Diabetes Translation, National Center for Chronic Disease Prevention and Health Promotion. December 2022.
Primary open-angle glaucoma. American Academy of Ophthalmology. EyeWiki. December 2021.
What is a glaucoma "suspect"? BrightFocus Foundation. July 2021.
Glaucoma tests. Cleveland Clinic. March 2022.
Tonometry. University of Michigan Health. January 2022.
PIO and tonometry. American Academy of Ophthalmology. EyeWiki. June 2022.
The eye exam for glaucoma. BrightFocus Foundation. July 2021.
Central corneal thickness measurements with different imaging devices: Ultrasound pachymetry, noncontact specular microscopy, and tono-pachymetry. Beyoglu Eye Journal. February 2022.
Diagnostic instruments. In Contact Lens Practice (Third Ed.). 2018.
Diagnosing glaucoma. NYU Langone Health. Accessed March 2023.
Imaging of the optic nerve: What is it and why is it needed? Glaucoma Research Foundation. January 2022.
Glaucoma: diagnosis and management. London: National Institute for Health and Care Excellence (NICE). January 2022.
Ganglion cell complex analysis in glaucoma patients: What can it tell us? Eye Brain. January 2020.
Gonioscopy. Cleveland Clinic. February 2022.
Current situation and progress of drugs for reducing intraocular pressure. Therapeutic Advances in Chronic Disease. December 2022.
Treatments for glaucoma. BrightFocus Foundation. Accessed March 2023.
Omlonti: Uses, dosage, side effects & warnings. Drugs.com. October 2022.
Topical carbonic anhydrase inhibitors. American Academy of Ophthalmology. EyeWiki. March 2023.
Nitric oxide donating anti-glaucoma drugs: advances and prospects. Chinese Journal of Natural Medicines. April 2020.
The role of nitric oxide in the intraocular pressure lowering efficacy of latanoprostene bunod: Review of nonclinical studies. Journal of Ocular Pharmacology and Therapeutics. March 2018.
Effects of selective EP2 receptor agonist, omidenepag, on trabecular meshwork cells, Schlemm’s canal endothelial cells and ciliary muscle contraction. Scientific Reports. August 2021.
Rho kinase inhibitors as a neuroprotective pharmacological intervention for the treatment of glaucoma. Cureus. August 2022.
Neuroprotection in glaucoma. American Academy of Ophthalmology. EyeWiki. April 2020.
Use of rho kinase inhibitors in ophthalmology: A review of the literature. Medical Hypothesis, Discovery & Innovation Ophthalmology Journal. Fall 2018.
Durysta (bimatoprost implant). American Academy of Ophthalmology. EyeWiki. December 2022.
Glaucoma laser and surgery. Wills Eye Hospital. Accessed March 2023.
Does marijuana help treat glaucoma or other eye conditions? American Academy of Ophthalmology. EyeSmart. December 2022.
Treating glaucoma. Glaucoma Research Foundation. Accessed March 2023.
Cannabis is associated with blood pressure reduction in older adults – A 24-hours ambulatory blood pressure monitoring study. European Journal of Internal Medicine. January 2021.
Eye drops vs. laser treatment for glaucoma. BrightFocus Foundation. July 2021.
Minimally invasive glaucoma surgery. StatPearls [Internet]. February 2023.
Glaucoma surgery. National Eye Institute. January 2022.
Glaucoma surgery series: Tube shunt drainage devices. BrightFocus Foundation. July 2021.
Comprehensive adult eye and vision examination, second edition. American Optometric Association. January 2023.
Pagina pubblicata in lunedì 3 maggio 2021
Pagina aggiornata in martedì 22 ottobre 2024
Revisionato dal punto di vista medico in martedì 25 aprile 2023






